Ácido nítrico usos y propiedades Cheblender información
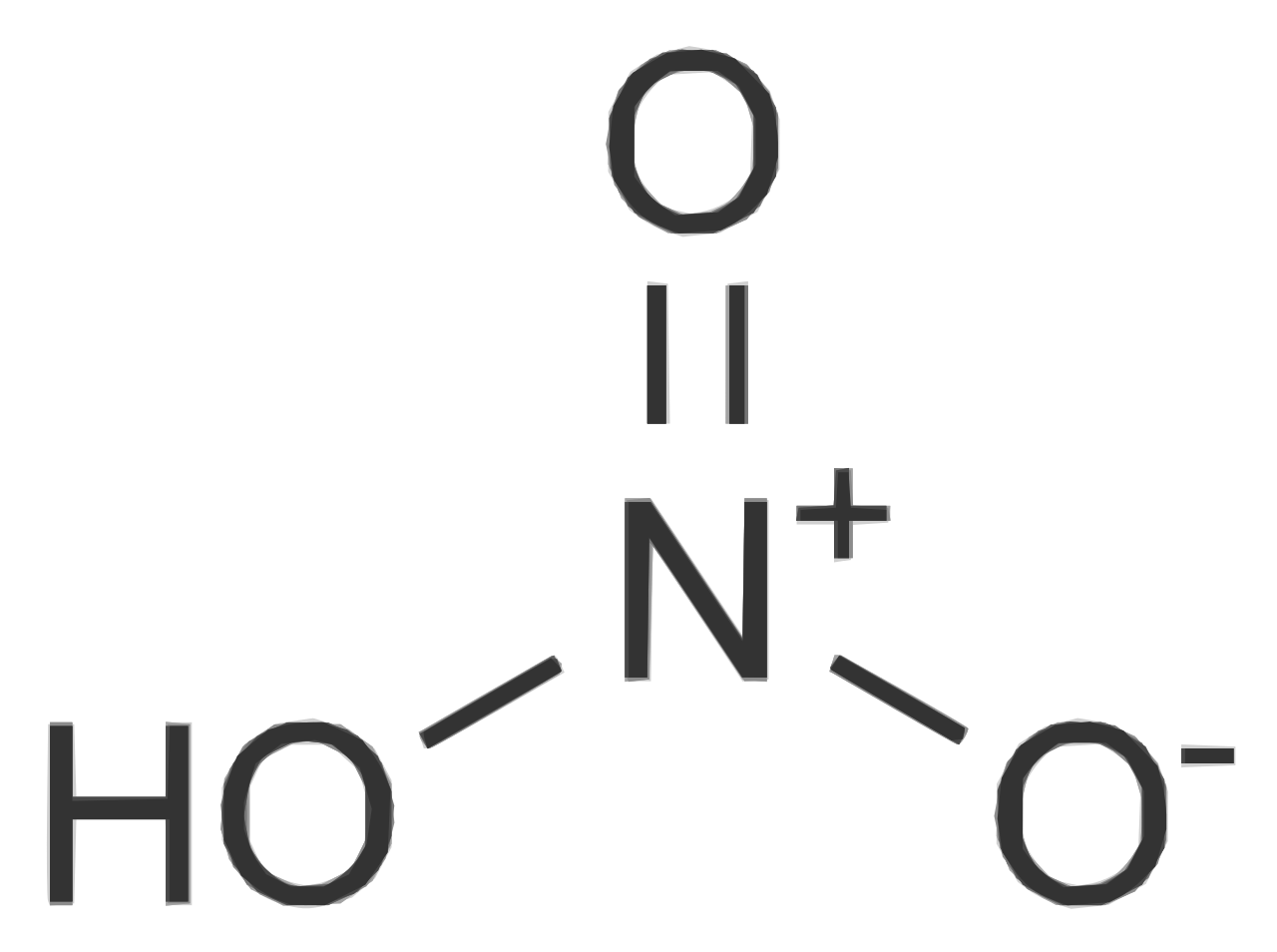
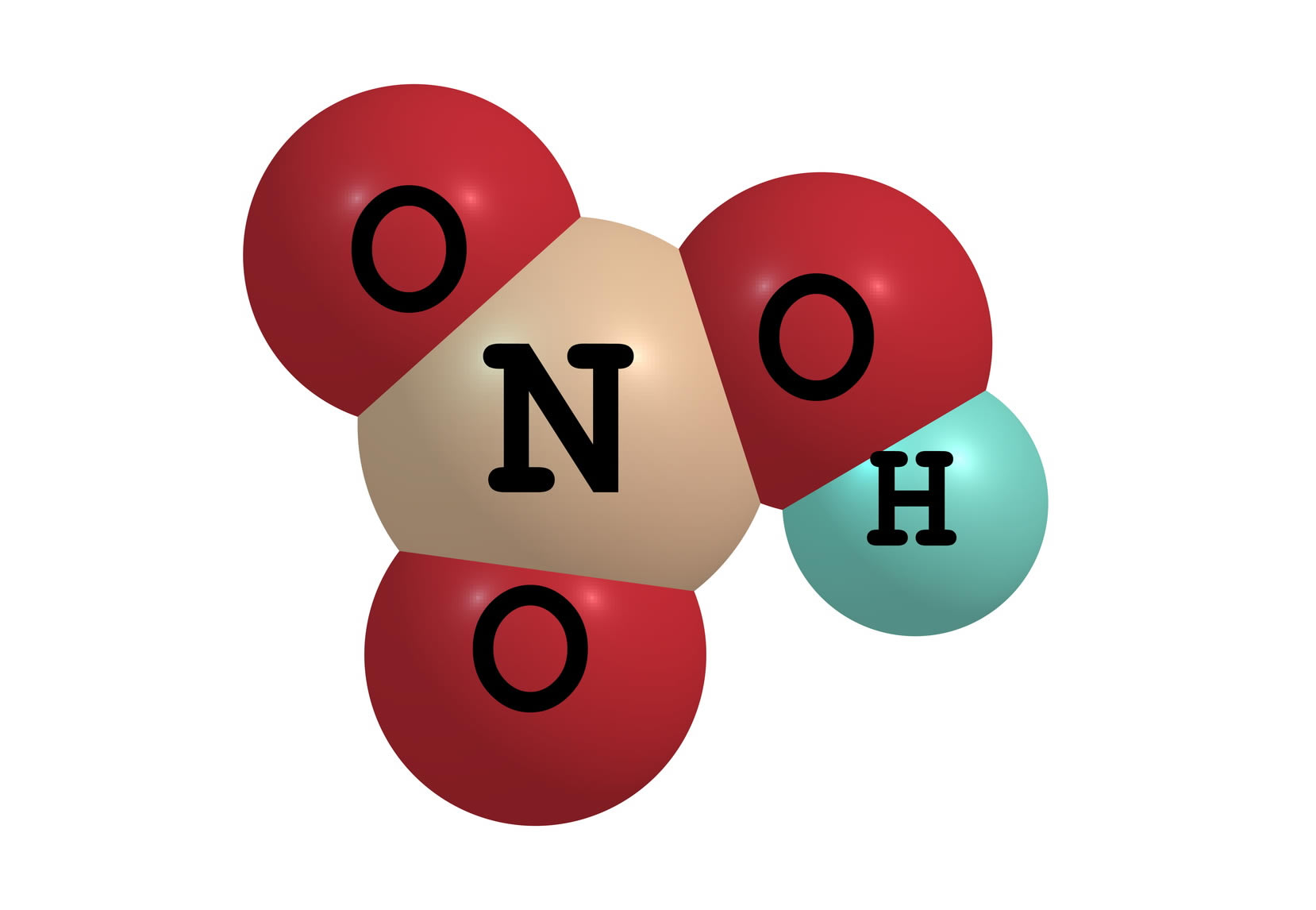
L'acido nitrico è l'ossiacido dell'azoto pentavalente, di formula HNO 3. È un acido minerale forte, nonché un forte agente ossidante dal sapore fortemente amaro e un odore pungente. Acido molto diffuso in commercio per l'ampio impiego in oreficeria e in artigianato nel settore della lavorazione artistica di oro, argento e platino e per il recupero e il riciclaggio di parti elettroniche.
Ácido Nítrico Conceito e o que é
Il pH di una soluzione in cui sono presenti un acido forte e uno debole è determinato dalla quantità di acido forte; l'acido debole è infatti poco ionizzato e, in presenza degli ioni H + rilasciati dall'acido forte, lo è ancor meno, tanto che si può ritenere nullo il suo contributo all'acidità della soluzione. Per determinare il valore del pH basta allora calcolare la.
Produto ACIDO NITRICO FUMEGANTE 99,5 Anidrol
Capire la forza di un acido. Per determinare se un acido è forte o debole, è possibile considerare diversi fattori: 1. Dissociazione ionica. Un acido forte si dissocia completamente in soluzione acquosa, producendo un elevato numero di ioni H+. Un acido debole, invece, si dissocia solo parzialmente, generando un numero limitato di ioni H+.
/cloudfront-us-east-1.images.arcpublishing.com/artear/H3W574KQG2BXSJUGZB3SNWFQCY.jpg)
Qué es el ácido nítrico y cómo afecta a la salud TN
Gli acidi che sono considerati forti in acqua includono l'acido cloridrico, l'acido iodidrico, l'acido nitrico, l'acido bromidrico, l'acido perclorico e l'acido solforico relativamente alla prima dissociazione. Al contrario, un acido debole, come l'acido acetico, non si dissocia completamente.

Diluendo soluzioni di un acido forte o debole
ACIDI E BASI 2. La Forza degli Acidi 2.1 Classificazione in base alla forza acida Gli acidi e le basi sono classificati come forti o deboli in base ai comportamenti che assumono in soluzione acquosa. Definiamo acidi forti quegli acidi che in acqua sono completamente dissociati in ioni.

Ácido Nítrico Laboratorios Athos
Fra i tanti acidi noti, sono pochi quelli che si comportano da acidi forti.. Tra questi ricordiamo l'acido perclorico HClO 4; l'acido nitrico HNO 3; HCl; HBr; HI. Gli idrossidi del I e del II gruppo della tavola periodica costituiscono invece le basi forti.Tra queste ricordiamo l'idrossido di sodio NaOH; LiOH; KOH; Ba(OH) 2. Alcuni idrossidi del gruppo II - l'idrossido di magnesio Mg(OH) 2 e l.

7 fatos interessantes sobre o ácido nítrico Clube da Química
HNO 3 , noto anche come acido nitrico, è considerato un acido forte a causa del suo elevato grado di ionizzazione in acqua. Quando un acido è classificato come "forte", significa che si dissocia completamente nei suoi ioni quando disciolto in acqua, determinando un'elevata concentrazione di ioni idrogeno (H+) nella soluzione.

ÁCIDO NÍTRICO 3750ML La Casa del Esparadrapo
La maggior parte degli acidi organici sono acidi deboli. Ecco un elenco parziale, ordinato dal più forte al più debole. H O 2 C 2 O 2 H - acido ossalico. H 2 SO 3 - acido solforoso. HSO 4 - - ione idrogeno solforato. H 3 PO 4 - acido fosforico. HNO 2 - acido nitroso. HF - acido fluoridrico. HCO 2 H - acido metanoico.

¿Cuáles son los usos principales del ácido nítrico? El blog de Patricia Mercado
Acidi e basi: forti e deboli Sappiamo che gli acidi hanno una caratteristica che li accomuna (in soluzione acquosa forniscono ioni H+), ma hanno anche una proprietà che li differenzia, cioè la «forza». Essa misura la capacità della molecola dell'acido di liberare più o. acido solforico H 2SO 4 acido nitrico HNO 3 acido iodico HIO 3

Diluendo soluzioni di un acido forte o debole
Quando si ha a che fare con un acido forte e una base debole, o viceversa, la curva di titolazione diventa più irregolare. Gli acidi e le basi deboli sono molecole che non si dissociano completamente quando sono in soluzione; in altre parole, non sono sali.Un esempio di acido debole è l'acido acetico (acido etanoico), mentre un esempio di base debole è l'ammoniaca.
Produto ACIDO NITRICO 65 PA Anidrol
Ad ogni acido forte corrisponderà una base coniugata debole, al contrario se l'acido fosse debole la sua base coniugata sarebbe forte. Per determinare se un acido è forte o debole si usa la costante di equilibrio. Consideriamo il caso di un acido generico: + +. = =. La concentrazione dell'acqua non si riporta perchè è considerato un.
Ácido NÍtrico Grupo SPD
Aggiornato il 07 novembre 2019. Un acido forte è uno che è completamente dissociato o ionizzato in una soluzione acquosa . È una specie chimica con un'elevata capacità di perdere un protone, H + . Nell'acqua, un acido forte perde un protone, che viene catturato dall'acqua per formare lo ione idronio: HA (aq) + H 2 O → H 3 O + (aq) + A −.

ACIDO NITRICO 65 P.A. (ACS) x 1000 ml BIOPACK MARBE S.A.
In chimica organica, si chiamano nitrati gli esteri dell'acido n. ottenuti per azione dell'acido n. o della miscela solfonitrica sugli alcoli. Sono liquidi di odore gradevole, instabili al riscaldamento. Molto importanti sono gli esteri dell'acido n. con gli alcoli polivalenti (nitroglicerina, nitrocellulosa).

Como Fazer ÁCIDO NÍTRICO do Ar YouTube
La neutralizzazione di acidi forti e di acidi deboli - Aula di Scienze. Scarica il PDF dell'articolo. Ho ricevuto da Claudia la seguente domanda: Non capisco perché, per neutralizzare 50 ml di acido acetico (CH3COOH) 1M, è necessario utilizzare la stessa quantità di NaOH che si utilizza per neutralizzare 50 ml di acido cloridrico (HCl) 1M.

Acido Nitrico cos'è, come viene utilizzato e perchè inquina
Tabella con i valori della K a e della K b dei principali acidi e basi. Per un generico acido HA che si dissocia in acqua secondo il seguente equilibrio: l'espressione della costante acida (k a) è la seguente: Tanto più questo valore è piccolo tanto meno forte è l'acido considerato. Il valore della costante acida è pertanto una misura di.
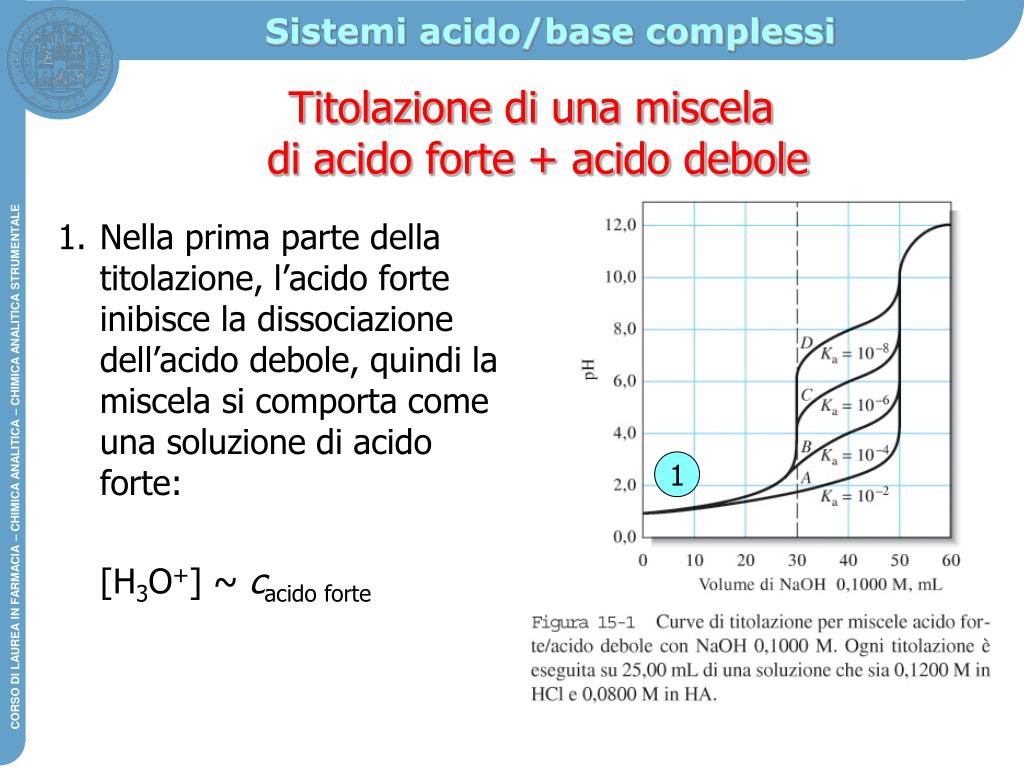
Grafico Titolazione Acido Debole Base Forte oqudina
Gli acidi forti sono acido cloridrico (HCl), acido nitrico (HNO3 ), acido solforico (H2SO4 ). Forte o debole rispetto a concentrato o diluito. Bisogna fare attenzione a non confondere i termini forte e debole con concentrato e diluito. Un acido concentrato ha una grande quantità di acido nella soluzione acquosa; uno diluito ha poca.
- Villa Almerico Capra Detta La Rotonda Vicenza
- Libro Il Gobbo Di Notre Dame
- Che Ore Sono Ad Istanbul
- La Vita è Un Palcoscenico Pirandello
- Vestiti Da Carnevale Di Gruppo
- Heroes And Might And Magic 5
- Come Si Chiamano Le Scuole Medie
- Stefania Rotolo Cocktail D Amore
- Poesia La Notte Santa Pdf
- Canale 5 Hd Frequenza 2023